L'Astaxanthine, un antioxydant surpuissant
23/01/2022L’ASTAXANTHINE, membre de la famille des caroténoïdes, est un pigment rouge foncé principalement issu du monde marin des algues et animaux aquatiques. L’astaxanthine est présente dans de nombreux aliments issus de la mer, y compris le saumon, la truite, la dorade de la mer rouge, les crevettes et les écrevisses, ainsi que chez des oiseaux tels que le flamand et la caille. Ce pigment est commercialisé à partir de la micro-algue Haematococcus pluvialis, source naturelle d’astaxanthine la plus riche qui soit.
Les caroténoïdes sont des pigments et antioxydants lipo-solubles, qui participent en tant que pigments accessoires au phénomène d’absorption de la lumière des organismes photosynthétiques. À ce jour, on a identifié plus de 600 caroténoïdes naturels. Ils sont responsables de la coloration orange ou rouge des plantes et des algues, ainsi que du vaste éventail de bleus, de violets et de rouges chez les animaux aquatiques. Seuls le phytoplancton, les algues, les plantes, certaines bactéries et champignons synthétisent les caroténoïdes. Les animaux et les êtres humains ont besoin d’un apport extérieur de caroténoïdes, qui doivent être inclus dans leur régime alimentaire.
Des découvertes scientifiques récentes indiquent que l’astaxanthine est l’un des plus puissants antioxydants et destructeur des radicaux libres (500 fois plus active que la vit. E). En outre, on a découvert que l’astaxanthine était à l’origine de nombreuses fonctions biologiques essentielles, y compris la protection contre la péroxydation, au niveau des membranes lipidiques, de protéines et d’acides gras polyinsaturés essentiels, la destruction de l’ADN et les effets des rayons UV ; elle joue également un rôle important au niveau des défenses immunitaires.
L’oxygène est nécessaire à la production métabolique d’énergie dans le corps. Les mitochondries, par un transfert d’électrons, utilisent l’oxygène pour oxyder certaines molécules et générer de l’énergie sous la forme d’ATP. Durant ce processus, l’oxygène est réduit en eau, produisant plusieurs radicaux libres dérivés de l’oxygène ou ROS, qui jouent un rôle important au niveau de diverses maladies. Normalement, les radicaux libres d’oxygène sont neutralisés par des antioxydants naturels tels que la vitamine E, ou des enzymes tels que la dismutase superoxydée (SOD). Cependant, les ROS deviennent problématiques quand leur disparition est moindre ou que leur production est plus importante. Un stress oxydatif en résulte. Ce stress, et les dommages ainsi occasionnés, jouent un rôle dans l’apparition de nombreuses maladies et une grande abondance de médicaments et de traitements préventifs font l’objet d’études actuelles.
L’activité puissamment antioxydante de l’astaxanthine a été mise en valeur dans de nombreuses études soulignant les effets destructeurs du stress oxydatif dû aux radicaux libres (2-4), ainsi que le potentiel possédé par l’astaxanthine pour aider au maintien de la santé. Il existe de plus en plus de témoignages montrant que l’astaxanthine améliore efficacement le bien-être général et le système immunitaire. Des études récentes ont mis en évidence qu’il y avait une meilleure réponse immunitaire et moins de dommages causés à l’ADN chez les êtres humains recevant de l’asthaxanthine (5). L’astaxanthine est capable de traverser la barrière sanguine du cerveau chez les mammifères (6), propriété rare et essentielle pour un antioxydant. Cette caractéristique permet à l’astaxanthine d’étendre son activité antioxydante exceptionnelle au système nerveux central, qui, étant riche en acides gras insaturés est extrêmement sensible aux attaques oxydatives des ROS (7).
La faculté de l’astaxanthine à limiter les dommages produits par le stress oxydatif dû aux ROS et à améliorer les paramètres propices à la santé dans les tissus et le corps a été démontrée dans une série d’expériences in-vitro, au cours d’études pré-cliniques, ou sur des êtres humains. Vous trouverez ci-dessous une liste de maladies et de facteurs contre lesquels il a été prouvé que l’astaxanthine avait des effets bénéfiques, comme l’ont décrit de nombreux articles médicaux, ainsi que d’excellentes revues spécialisées (8,9) ces dix dernières années :
• La dégénérescence de la macula liée à l’âge, principale cause de cécité chez les personnes âgées.
De nombreuses données indiquent que certains caroténoïdes peuvent participer à la protection de la rétine contre les dommages oxydatifs. Une étude sur des rats montre que l’astaxanthine atténue efficacement des lésions rétiniennes tout en protégeant les photorécepteurs de la dégénérescence. Les résultats de cette étude suggèrent que l’astaxanthine pourrait être bénéfique dans la prévention et le traitement des lésions neuronales associées à la dégénérescence maculaire liée à l’âge (Tso M.O. et al., Method of retarding and ameliorating central nervous system and eye damage, US patent #5527533, Board of trustees of the University of Illinois, United States of America, 1996). Les photorécepteurs des animaux nourris avec de l’astaxanthine étaient moins endommagés par l’attaque des rayons UV et guérissaient plus rapidement que ceux des rats n’ayant pas reçu d’astaxanthine.
• Les maladies d’Alzheimer et de Parkinson, deux des maladies neurologiques les plus importantes.
• Le cholestérol : l’astaxanthine diminue les effets du LDL, ou « mauvais » cholestérol.
• Les maladies inflammatoires, virales chroniques et auto-immunes.
On a montré que l’astaxanthine diminue chez le rat une enflure induite alors que la vitamine E reste sans effet. (Kurashige M. et al., Inhibition of oxidative injury of biological membranes by astaxanthin, Physiol. Chem. Phys. Med., 1990, NMR 22, 27-38.) Elle aide également à combattre les symptômes de la maladie ulcéreuse liée à Helicobacter pylori. Elle réduit les symptômes de l’inflammation gastrique et est également associée à une modification de la réponse à l’inflammation (Bennedsen M. et al., Treatment of H. pylori infected mice with antioxidant astaxanthin reduces gastric inflammation, bacterial load and modulates cytokine release by splenocytes, Immunol. Lett., 1999, 70, 185-189.) On peut penser que les propriétés antioxydantes de l’astaxanthine expliquent son rôle dans l’inflammation.
• La dyspepsie.
• Les brûlures causées par les UV.
• L’hyperplasie bénigne de la prostate (BPH)
• Les attaques : l’astaxantine répare les dommages causés par le manque d’oxygène.
• L’astaxanthine augmente la fertilité du sperme.
• L’astaxanthine améliore la fonction musculaire.
• L’astaxanthine régularise le rythme cardiaque.
Chez l’homme, l’astaxanthine est transportée par les VLDL, les LDL et les HDL. Dans un test in vitro et une étude sur des sujets humains, l’ingestion quotidienne de 3,6 mg d’astaxanthine pendant deux semaines consécutives protégeait le cholestérol-LDL d’une oxydation induite in vitro. Dans une étude sur un modèle animal, une supplémentation en astaxanthine avait pour résultat une augmentation des niveaux sanguins de cholestérol-HDL, la forme de cholestérol sanguin inversement associé aux maladies cardio-vasculaires. L’astaxanthine pourrait ainsi exercer une action bénéfique pour la santé du cœur en modifiant les niveaux de cholestérol-LDL et HDL mais, également, en réduisant l’inflammation supposée être associée au développement des maladies cardio-coronariennes.
• C’est un agent anti-hypertension.
• L’astaxanthine renforce les fonctions immunitaires
Un certain nombre d’essais in vitro et in vivo sur des modèles animaux a montré que l’astaxanthine influence significativement la fonction immunitaire. In vitro, l’astaxanthine stimule la production d’anticorps par des cellules de rate de souris stimulées avec des globules rouges de moutons (Jyonuchi H. et al., Studies of immunomodulating actions of carotenoids. I. Effects of beta-carotene and astaxanthine on murine lymphocyte functions and cell surface marker expression in in vitro culture system, Nutr. Cancer, 1991, 16 (2): 93-105). Cette action s’exerce au moins en partie sur les cellules T et, plus particulièrement, sur les cellules T auxiliaires (Jyonouchi H. et al., Studies of immunomodulating actions of carotenoids. II. Astaxanthin enhances in vitro antibodies production to T-dependent antigens without facilitating polyclonal B-cell activation, Nutr. Cancer, 1993, 19(3): 269-280). Chez des souris âgées, l’astaxanthine peut partiellement restaurer la réponse immunitaire humorale diminuée (Jyonuchi H. et al., Immunomodulating actions of carotenoids: enhancement of in vivo and in vitro antibody production to Tdependent antigens, Nutr. Cancer, 1994, 21 (1) : 47-58). Des études in vitro sur des cellules de sang humain ont démontré que l’astaxanthine stimule la production d’immunoglobuline en réponse à des stimuli dépendant des cellules T.
• L’astaxanthine et le cancer
Plusieurs études ont montré, chez des mammifères, une activité anticancéreuse de l’astaxanthine. Ainsi, l’une d’entre elles a mis en évidence, chez des souris, un effet protecteur contre la carcinogenèse de la vessie. Les chercheurs ont nourri deux groupes de souris (respectivement 36 et 33 animaux) avec un carcinogène pendant 22 semaines. Ce carcinogène a ensuite été éliminé de l’alimentation des animaux. Après une semaine d’intervalle, le second groupe de souris a reçu dans son alimentation de l’astaxanthine pendant vingt semaines. L’examen histologique a permis de constater une incidence de 42 % des carcinomes de la vessie dans le groupe non supplémenté et de seulement 18 % dans celui ayant reçu de l’astaxanthine (Tanaka T. et al., Chemoprevention of mouse urinary bladder carcinogenesis by the naturally occuring carotenoid astaxanthin, Carcinogen, 1994, 15:15-19). Dans une seconde étude, les chercheurs ont montré chez des rats que l’astaxanthine pouvait prévenir la carcinogenèse buccale. Ils ont donné à deux groupes d’animaux un carcinogène connu, l’un d’eux recevant en plus de l’astaxanthine. Ils ont constaté une plus faible incidence de différents types de croissances cancéreuses dans la gueule des rats ayant pris de l’astaxanthine que dans celle de ceux n’ayant reçu que le carcinogène. Les chercheurs en ont conclu que l’astaxanthine offrait une protection efficace contre le cancer buccal (Tanaka T. et al., Chemoprevention of 4-nitroquinoline-1-oxide-induced oral carcinogenesis by dietary curcumin and hesperidin: comparison with the protective effect of beta-carotene, Cancer Res., 1994, 54: 4653-4659). L’activité anticancéreuse de l’astaxanthine peut être liée au rôle que jouent les caroténoïdes dans la communication cellulaire au niveau des gap junctions.
ARTICLES MÉDICAUX ET APPLICATIONS NUTRACEUTIQUES DE L’ASTAXANTHINE
Les chercheurs médicaux ont montré que l’astaxanthine avait probablement des applications pharmaceutiques importantes. Des expériences in-vitro, des études pré-cliniques in vivo et des débuts de tests cliniques ont clairement indiqué que l’astaxanthine par elle-même, ou conjuguée avec d’autres éléments, se comportait à la façon d’un agent prophylactique et comme un facteur de guérison contre diverses maladies et mauvais états de santé
ARTICLES SUR LES APPLICATIONS DE L’ASTAXANTHINE SUR LA SANTE
MALADIES REFERENCE
|
Système nerveux central et maladies neurodégénéradatives |
6 |
|
Santé de l'œil |
6, 23 - 26 |
|
Santé des os, endurance musculaire |
27, 28 |
|
Inflammation et système immunitaire |
5, 29 - 46 |
|
cardiovasculaira, cœur, lipide |
47 - 53 |
|
cancer |
49, 54 - 65 |
|
fertilité |
66, 67 |
|
Soleil et santé de la peau, anti-âge |
26, 68 - 72 |
|
hyperplasie benigne de la prostate (BPH) |
73 |
Il existe actuellement une demande croissante d’astaxanthine au sein du marché nutraceutique qui, en pleine expansion, brasse des millions de dollars ; en particulier des preuves de plus en plus importantes suggèrent que l’astaxanthine est un antioxydant beaucoup plus puissant que les vitamines C et E ou que d’autres caroténoïdes tels que le bêta-carotène, le lycopène, la lutéine et la zéaxanthine, entre autres.
L’efficacité de l’astaxanthine est sans doute due à sa structure moléculaire. L’astaxanthine appartient au groupe xanthophylle des caroténoïdes, ou caroténoïdes oxygénés (voir d’autres éléments de ce groupe Fig. 1). Les groupes fonctionnels d’hydroxyles et de kéto (voir Fig. 1) présents dans le cycle ionone terminal (ending ionone ring) d’asthaxanthine est sans doute responsable de son activité antioxydante exceptionnelle et de sa faculté à infiltrer les membranes à double monocouches en conséquence directe de sa polarité plus importante (its more polar configuration) que celle des autres caroténoïdes (3, 10-14). Les caroténoïdes dont les groupes terminaux présentent une polarité (with polar end groups) comme l’astaxanthine infiltrent les doubles monocouches des membranes lipidiques, leurs groupes terminaux étant situés près de l’interface hydrophobe-hydrophile, où se produit d’abord les attaques de radicaux libres.
On pense que c’est l’heamatococcus pluvialis qui accumule dans la nature les taux les plus élevés d’astaxanthine. Lorsqu’elle est cultivée commercialement, cette micro-algue peut accumuler plus de 40 g d’astaxanthine par kilo de biomasse sèche (voir le tableau 1).
TABLEAU 1 – SOURCES NATURELLES D’ASTAXANTHINE
Sources naturelles d’astaxanthine et Concentrations d’astaxanthine (ppm)
Salmonidés......................5
Plancton..........................60
Krill................................120
Crevette arctique.............1200
Levures de phaffia............8000
Haematococcus pluvialis ...40000
L’astaxanthine sert principalement aujourd’hui comme complément alimentaire destiné à donner de la coloration aux salmonidés (saumons et truites) et aux dorades de la mer rouge. Dans leur habitat naturel, les salmonidés obtiennent leur coloration de sources alimentaires naturelles incluant algues et crustacés. Cependant, dans les élevages, l’absence de sources naturelles de pigmentation produit des salmonidés plus ou moins blancs, ce qui leur donne un aspect artificiel et peu attrayant pour la consommation, les rendant difficiles à commercialiser.
Aujourd’hui, essentiellement, l’ensemble de l’astaxanthine commercialisée pour l’aquaculture est produite synthétiquement par l’industrie pétrochimique, avec un chiffre d’affaires annuel dépassant les 200 millions de dollars et un prix de vente de 2000 dollars le kg d’astaxanthine pure. La production de volailles et d’œufs est une autre application en plein essor de l’astaxanthine de synthèse.
Ces dernières années, on a vu s’affermir la tendance à utiliser des ingrédients naturels pour toutes les formes de nutriments, liée à un souci croissant pour la sécurité du consommateur et la réglementation concernant l’introduction de produits chimiques de synthèse dans la chaîne alimentaire humaine. C’est également vrai pour les marchés de la nutraceutique et de la cosmétique. Le bêta-carotène, le lycopène, la lutéine et la zéasanthine, caroténoïdes aux propriétés antioxydantes, sont de bons exemples de dérivés naturels de caroténoïdes commercialement importants. Ces substances sont devenues des ingrédients populaires de nombreux compléments alimentaires vitaminés et minéralisés. Le bêta-carotène et le lycopène peuvent être produits à la fois synthétiquement (par l’industrie pétrochimique) et naturellement. Il y a une décennie, le bêta-carotène naturel ne représentait qu’un tout petit pourcentage du marché mondial. Depuis, ce dernier a doublé ou triplé et, aujourd’hui, le bêta-carotène naturel représente 15 à 20 % de la demande mondiale (15). En fait, tous les producteurs nutraceutiques utilisent des caroténoïdes naturels plutôt que synthétiques et versent des taxes cinq fois plus élevées que s’il s’agissait de produits de synthèse.
La demande d’astaxanthine naturelle commence à se faire sentir sur le marché nutraceutique et, de plus en plus, les chercheurs en médecine pensent que l’astaxanthine aura d’importantes applications pharmaceutiques. Si elle ne représente qu’une part négligeable du marché actuel, on s’attend à ce que la demande augmente de façon considérable prochainement à la suite des nombreuses études médicales faites ces cinq dernières années sur les applications de l’astaxanthine. De plus en plus d’études confirment qu’une dose quotidienne de 5 mg d’astaxanthine serait d’une grande importance pour la santé, en protégeant les cellules et les tissus du stress oxydatif causé par les radicaux libres, entre autres.
Les producteurs d’astaxanthine ont entrepris ces dernières années plusieurs études montrant l’absence d’effets secondaire de l’astaxanthine naturelle dérivée de l’haematococcus (16-18). Un test randomisé de huit semaines en double-aveugle, contrôlé par placebo et destiné à déterminer l’innocuité de l’astaxanthine chez trente-cinq adultes sains a récemment été publié (19). Les résultats ont révélé que des adultes sains peuvent consommer quotidiennement sans effets secondaires 6 mg d’astaxanthine issus d’un extrait d’haematococcus pluvialis. Si l’on se fonde sur des découvertes récentes, nous pensons qu’une dose quotidienne d’astaxanthine aurait un impact préventif important sur toute une série de maladies liées à l’âge. En outre, de petites doses quotidiennes d’astaxanthine pourrait éviter ou retarder l’apparition de certaines maladies, épargnant ainsi à la société des frais importants.
ASTAXANTHINE NATURELLE OU SYNTHÉTIQUE ?
La différence chimique entre l’astaxanthine naturelle et l’astaxanthine synthétique tient à l’orientation stéréochimique des molécules dans l’espace (molécules dites « énantiomères »).
L’astaxanthine existe sous trois principales formes énantiomériques (3S-3’S ; 3R-3’S ; 3R-3’R) selon l’orientation spatiale des groupes d’hydroxyle (OH) dans le carbone chiral numéro 3 (voir Fig. 1). Pour parler simple, la chiralité et la différentiation stéréo sont des facteurs cruciaux de l’activité biologique, parce que dans la nature, au niveau moléculaire, l’asymétrie domine les processus biologiques, tels que les réactions enzymatiques et la plupart des réactions immunitaires. La chiralité n’est pas indispensable à la bioactivité, mais dans les molécules bioactives, où au moins un centre chiral est présent, de grandes différences sont généralement observées dans l’activité des différents énantiomères. C’est là un phénomène général qui s’applique à de nombreuses substances bioactives, telles que les médicaments, les odeurs, les parfums et les compléments alimentaires.
Une étude récente a montré qu’il était facile de distinguer le saumon d’élevage – c’est-à-dire la plupart des saumons vendus dans les supermarchés -- du saumon sauvage grâce à ses isomères d’astaxanthine, parce que les saumons d’élevage sont nourris avec de l’astaxanthine synthétique (20). Le pigment des saumons sauvages existe principalement sous la forme énantiomérique 3S-3’S, la même que celle de l’haematococcus. L’astaxanthine synthétique de la pétrochimie contient un mélange de tous les énantiomères de l’astaxanthine, résultat direct de sa synthèse chimique, principalement (à 50 %) sous la forme 3R-3’S (ou mésoforme). Et certes, dans une belle étude sur l’être humain, Osterlie et co. (74-76) ont découvert que ce dernier absorbait de façon sélective les différents isomères, dont les concentrations différaient selon les organes. Il est important de noter que presque toutes les études soulignant les effets bénéfiques de l’astaxanthine sur la santé humaine ont été faites sur le stéréoisomère de l’haematococcus, 3S-3’S. Même si les autres stéréoisomères ne sont sans doute pas nocifs, aucun effet biologique significatif n’a été noté.
En outre, l’astaxanthine naturelle existe dans les algues et les poissons sous forme de mono et di-esters d’acides gras, tandis que l’astaxanthine synthétique est produite et vendue pour le saumon d’élevage sous forme d’hydroxyle libre. En ce qui concerne les applications nutraceutiques également, les scientifiques ont démontré que l’un des principaux avantages des esters de l’astaxanthine naturelle est lié au fait que la forme estérifiée est plus stable que la forme libre, sa durée de conservation avant oxydation étant en conséquence plus longue. Plusieurs études récentes mettent clairement en valeur les effets positifs des esters de l’astaxanthine en mélange avec des formulations lipidiques sur la bio-efficacité orale de l’astaxanthine chez l’être humain (21,22).
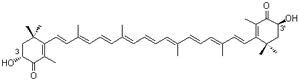
Astaxanthin 3S, 3’S
Zeaxantin
PRODUCTION D’ASTAXANTHINE NATURELLE PAR L’HEAMATOCOCCUS PLUVIALIS
La microalgue haematococcus pluvialis synthétise et accumule de l’astaxanthine à des taux relativement élevés. Le processus commercial de production se fonde sur deux stades de culture distincts. Le premier est appelé « stade vert » et commence à l’intérieur avec une colonie de cellules uniques de microalgues. Il se poursuit ensuite à l’extérieur sous des photobioréacteurs solaires. Ce stade est destiné à produire une grande quantité de cellules d’algue verte viables et non stressées par division cellulaire normale (voir Fig. 2). Ce « stade vert » offre des conditions de croissance optimales afin de produire un taux maximal de production de biomasse. Le second stade de culture est le « stade rouge » (voir Fig. 2), au cours duquel les cellules de l’algue synthétisent et accumulent le pigment d’astaxanthine. À ce stade, on soumet les cellules à un rayonnement lumineux intense et à des changements dans les modes de croissance. En conséquence, les cellules de l’haematococcus durcissent leurs membranes, synthétisant et accumulant de l’astaxanthine sous forme d’esters. La culture d’algue dans des systèmes clos permet de contrôler un environnement biologiquement et chimiquement moins contaminé. Suite au « stade rouge », le taux d’astaxanthine dans les « cellules rouges » peut atteindre jusqu’à 4 % du poids sec. La quantité d’astaxanthine dans les « cellules rouges » est liée à la sévérité des conditions de stress, notamment au rayonnement lumineux. Ensuite, la culture « rouge » est pompée dans la zone de conditionnement, où les cellules sont éclatées (pour rendre le pigment biodisponible), séchées et enveloppées sous vide. Le stade suivant consiste à produire de l’oléorésine d’haematococcus, en utilisant un processus d’extraction fluide extrêmement pointu avec du CO2 (CO2 Supercritical Fluid Extraction). De plus en plus, consommateurs et organismes de contrôle exigent des extraits sans solvants résiduels. L’extraction supercritique permet de travailler à plus faible température (~ 40°C), ce qui ne dénature pas les principes actifs de l’extrait obtenu, qui sont alors très proches de celles de la matière première végétale. Elle permet également d’obtenir des extraits 100% naturels indemnes de tous résidus de solvant d’extraction. L’extraction au CO2 supercritique est l’une des rares technologies d’extraction compatible avec le cahier des charges de l’agriculture biologique.
Peu d’entreprises commercialisent de l’astaxanthine issue de l’haematococcus pluvialis. Pour la fabrication d’Astaxanthin80 ou 120, on utilise des photobioréacteurs solaires tubulaires pour le « stade vert » comme pour le « stade rouge » au sein de systèmes fermés contrôlés de façon stricte (voir Fig. 3 et 4). Nous utilisons l’astaxanthine à partir de la microalgue haematococcus pluvialis selon un processus de croissance biocontrôlé et breveté (1).
Un produit contenant de grandes quantités d’astaxanthine, ayant une faible contamination biologique et chimique et une excellente stabilité -- tels sont les principaux paramètres garantissant une excellente qualité commerciale de la biomasse et des oléorésines d’haematococcus. La production d’astaxanthine dans un système clos tout au long du processus dans son ensemble (stades vert et rouge) dans un environnement ensoleillé, donne un pigment de grande qualité (voir Fig. 5). La biomasse de l’algue contient une concentration d’astaxanthine de 4 % du poids sec. La production de la biomasse sous forme de flocons (comme pour la biomasse sèche d’Astaxanthine) offre des avantages supplémentaires quand un processus d’extraction est exigé en vue d’une production d’oléorésine d’excellente qualité comportant une concentration d’astaxanthine de 5 à 10 %.

Fig. 2 : Stade rouge de culture d’heamatococcus pluvialis (partie de la photo en rouge).
Stade vert de culture d’heamatococcus pluvialis (partie de la photo en vert).

Fig. 3 : Vue générale d’une production d’algues.

Fig. 4 : Photoréacteurs solaires du « stade rouge » -- vue générale.

Fig. 5 : Biomasse d’algues haematococcus pluvialis éclatées et séchées.
REFERENCES
1-Boussiba S.; Vonshak A.; Cohen Z.; Richmond A. (1997)
A procedure for large scale production of Astaxanthin from Haematococcus. WO 97/28274.
2- Papas, A.M. (1999)
Antioxidant Status, Diet, Nutrition, and Health. CRC Press.
3- Palozza, P. and Krinsky, N.I. (1992)
Astaxanthin and canthaxanthin are potent antioxidants in a membrane model. Arch. Biochem. Biophys. 297: 291–295.
4- Naguib, Y.M.A. (2000)
Antioxidant activities of astaxanthin and related carotenoids. J. Agric. Food Chem. 48: 1150–1154.
5- Chew B.P. and Park J.S., (October 2003)
Dissertation in Supply Side West. Las Vegas.
6- Tso, M.O.M. and Lam, T-T. (1996)
Method of Retarding and Ameliorating Central Nervous System and Eye Damage. Assigned to U. S. Nutraceuticals. U.S. Patent #5527533.
7- Facchinetti F.; Dawson VL.; Dawson TM. (1998)
Free radicals as mediators of neuronal injury. Cell Mol Neurobiol.18(6):667-82.
8- Lorenz, R.T. and Cysewski, G.R. (2000)
Commercial potential for Haematococcus microalgae as a natural source of astaxanthin. Trends in Biotechnol. 18: 160–167.
9 - Guerin, M.; Huntley M. E.; and Olaizola M. (2003)
Haematococcus astaxanthin: applications for human health and nutrition. Trends in Biotechnol. 21: 210-216.
10- Shibata A.; Kiba Y.; Akati N.; Fukuzawa K.; Terada H. (2001)
Molecular characteristics of astaxanthin and beta-carotene in the phospholipid monolayer and their distributions in the phospholipid bilayer. Chem Phys Lipids113(1-2): 11-22.
11- Goto S.; Kogure K.; Abe K.; Kimata Y.; Kitahama K.; Yamashita E.; Terada H. (2001)
Efficient radical trapping at the surface and inside the phospholipid membrane is responsible for highly potent antiperoxidative activity of the carotenoid astaxanthin. Biochim Biophys Acta1512(2): 251-8.
12- Oshima S.; Ojima F.; Sakamoto H.; Ishiguro Y.; Terao J. (1993)
Inhibitory effect of beta-carotene and astaxanthin on photosensitized oxidation of phospholipid bilayers. J Nutr Sci Vitaminol (Tokyo) 39(6): 607-15.
13- Kurashige M.; Okimasu E.; Inoue M.; Utsumi K. (1990)
Inhibition of oxidative injury of biological membranes by astaxanthin. Physiol Chem Phys Med NMR 22(1): 27-38.
14 - Nakagawa K.; Kang SD.; Park DK.; Handelman GJ.; Miyazawa T. (1997)
Inhibition of beta-carotene and astaxanthin of NADPH-dependent microsomal phospholipid peroxidation. J Nutr Sci Vitaminol (Tokyo) 43(3): 345-55.
15– Bahner, B. (1993)
Beta –carotene use grows; natural sector in flux. Chemical Market Reporter 244:26-27.
16- Cyanotech Corporation –
Technical paper available at: http://www.cyanotech.com/pdfs/axbul60.pdf
17 - Mera Pharmaceuticals (1999)
Haematococcus pluvialis and astaxanthin safety for human consumption.
Technical Report TR.3005.001 available at http://www.astafactor.com/techreports/tr3005-001.htm
18 – La Haye - US Nutraceuticals
Technical paper available at: http://www.lahaye.com/safety.html
19- Spiller GA.; Dewell A. (2003)
Safety of an Astaxanthin-Rich Haematococcus pluvialis Algal Extract: A Randomized Clinical Trial. J Med Food 6(1): 51-6.
20- Turujman, S.A. et al. (1997)
Rapid liquid chromatographic method to distinguish wild salmon from aquacultured salmon fed synthetic astaxanthin. J. AOAC Int. 80: 622–632.
21- Mercke Odeberg J.; Lignell A.; Pettersson A.; Hoglund P. (2003)
Oral bioavailability of the antioxidant astaxanthin in humans is enhanced by incorporation of lipid based formulations. Eur J Pharm Sci 19(4): 299-304.
22- Clark RM.; Yao L.; She L.; Furr HC. (2000)
A comparison of lycopene and astaxanthin absorption from corn oil and olive oil emulsions. Lipids 35(7): 803-6.
23 - Snodderly D.M. (1995)
Evidence for protection against age related macular degeneration by caretonoids and antioxidant vitamins. Amer J. Clinical Nutrition. 63(s):1448S-1461S.
24- Ohgami K.; Shiratori K.; Kotake S.; Nishida T.; Mizuki N.; Yazawa K.; Ohno S. (2003)
Effects of astaxanthin on lipopolysaccharide-induced inflammation in vitro and in vivo. Invest Ophthalmol Vis Sci . 44(6): 2694-701.
25 - Waagbo R.; Hamre K.; Bjerkas E.; Berge R.; Wathne E.; Lie O.; Torstensen B. (2003)
Cataract formation in Atlantic salmon, Salmo salar L., smolt relative to dietary pro- and antioxidants and lipid level . J Fish Dis. 26(4): 213-29.
26- O’Connor I.; O’Brien N. (1998)
Modulation of UVA light-induced oxidative stress by beta-carotene, lutein and astaxanthin in cultured fibroblasts. J Dermatol Sci . 16(3): 226-30.
27 - Malmsten C. (1998)
Dietary supplementation with astaxanthin rich algal meal improves muscle endurance – a double blind study on male students. Unpublished study from the Karolinska Institute. Gustavberg, Sweden.
28- Lignell A. (2001)
Medicament for improvement of duration of muscle function or treatment of muscle disorders or diseased. US patent # 6,245,818 Astacarotene AB Sweden.
29- Bennedsen, M. et al. (1999)
Treatment of H. pylori infected mice with antioxidant astaxanthin reduces gastric inflammation, bacterial load and modulates cytokine release by splenocytes. Immunol. Lett. 70: 185–189.
30- Wang X.; Willen R.; Wadstrom T. (2000)
Astaxanthin-rich algal meal and vitamin C inhibit Helicobacter pylori infection in BALB/cA mice. Antimicrob Agents Chemother 44(9): 2452-7.
31-Lignell, A. (1998)
Treatment of Dyspepsia, Patent no. WO 00/23064
32- Anderson T.; Pettersson S. (2001)
Method of inhibiting the expression of inflammatory cytokines. Patent no. WO 0172296.
33- Lorenz T. et al. (2000)
Method of retarding Ameliorating Carpel tunnel syndrome, US Patent #. 6,258,855.
34- Hughes D.A. (1999)
Effects of dietary antioxidants on the immune function of the middle aged. Proc. Nutr. Soc 58(1): 79-84.
35- Lignell A. (2001)
Use of xanthophylls, Astaxanthin e.g. for the treatment of autoimmune diseases, chronic viral and intracellular bacterial infections. Patent # WO 01/24787.
36- Lignell A. et al. (1998)
Method for the prophylactic treatment of mastitis. WO99/30701.
37- Jyonouchi, H. et al. (1995)
Effect of carotenoids on in vitro immunoglobulin production by human peripheral blood mononuclear cells: astaxanthin, a carotenoid without vitamin A activity, enhances in vitro immunoglobulin production in response to a T-dependent stimulant and antigen. Nutr. Cancer 23: 171–183.
38- Lee SJ.; Bai SK.; Lee KS.; Namkoong S.; Na HJ.; Ha KS.; Han JA.; Yim SV.; Chang K.; Kwon YG.; Lee SK.; Kim YM. (2003)
Astaxanthin inhibits nitric oxide production and inflammatory gene expression by suppressing I(kappa)B kinase-dependent NF-kappaB activation. Mol Cells Korea 16(1): 97-105.
39- Chew BP.; Wong MW.; Park JS.; Wong TS. (1999)
Dietary beta-carotene and astaxanthin but not canthaxanthin stimulate splenocyte function in mice. Anticancer Res. 19(6B): 5223-7.
40- Jyonouchi H.; Zhang L.; Tomita Y. (1993)
Studies of immunomodulating actions of carotenoids. II. Astaxanthin enhances in vitro antibody production to T-dependent antigens without facilitating polyclonal B-cell activation. Nutr Cancer 19(3): 269-80.
41- Jyonouchi H.; Hill RJ.; Tomita Y.; Good RA. (1991)
Studies of immunomodulating actions of carotenoids. I. Effects of beta-carotene and astaxanthin on murine lymphocyte functions and cell surface marker expression in in vitro culture system. Nutr Cancer 16(2): 93-105.
42- Akyon Y. (2002 )
Effect of antioxidants on the immune response of Helicobacter pylori. Clin Microbiol Infect. 8(7): 438-41.
43- Okai Y.; Higashi-Okai K. (1996)
Possible immunomodulating activities of carotenoids in in vitro cell culture experiments. Int J Immunopharmacol 18(12): 753-8.
44- Jyonouchi H.; Sun S.; Mizokami M.; Gross MD. (1996)
Effects of various carotenoids on cloned, effector-stage T-helper cell activity. Nutr Cancer 26(3): 313-24.
45- Jyonouchi H.; Sun S.; Tomita Y.; Gross MD. (1995)
Astaxanthin, a carotenoid without vitamin A activity, augments antibody responses in cultures including T-helper cell clones and suboptimal doses of antigen. J Nutr 125(10): 2483-92.
46- Jyonouchi H.; Zhang L.; Gross M.; Tomita Y. (1994)
Immunomodulating actions of carotenoids: enhancement of in vivo and in vitro antibody production to T-dependent antigens. Nutr Cancer 21(1): 47-58.
47- Murillo E. (1992)
Cholesterolemic effects of canthaxanthin & astaxanthin in rats. Arc Latinoam Nutr. 42: 409-13.
48- Iwamoto T.; Hoosoda K.; Hirano R.; Kurata H.; Matsumoto A.; Miki W.; Kamiyama M.; Itakaru H.; Yamamoto S.; Kondo K. (2001)
Inhibition of low-density lipoprotein oxidation by astaxanthin. J Atheroscler Thromb 7: 216-22
49- Zhang LX.; Cooney RV.; Bertram JS. (1991)
Astaxanthin limits exercise-induced skeletal and cardiac muscle damage in mice. in C3H/10T1/2 cells: relationship to their cancer chemopreventative action. Carcinogenesis 12(11): 2109-14.
50- Aoi W.; Naito Y.; Sakuma K.; Kuchide M.; Tokuda H.; Maoka T.; Toyokuni S.; Oka S.; Yasuhara M.; Yoshikawa T. (2003)
Astaxanthin limits exercise-induced skeletal and cardiac muscle damage in mice. Antioxid Redox Signal 5(1): 139-44.
51- Kang JO.; Kim SJ.; Kim H. (2001)
Effect of astaxanthin on the hepatotoxicity, lipid peroxidation and antioxidative enzymes in the liver of CCl4-treated rats. Methods Find Exp Clin Pharmacol. 23(2): 79-84.
52- Murillo E. (1992)
Hypercholesterolemic effect of canthaxanthin and astaxanthin in rats. Arch Latinoam Nutr 42(4): 409-13.
53-Rengel D.; Diez-Navajas A.; Serna-Rico A.; Veiga P.; Muga A.; Milicua JC. (2000)
Exogenously incorporated ketocarotenoids in large unilamellar vesicles. Protective activity against peroxidation. Biochim Biophys Acta 1463(1): 179-87.
54- Jyonouchi H.; Sun S.; Iijima K.; Gross MD. (2000)
Antitumour activity of astaxanthin and its mode of action. Nutr cancer 36(1): 59-65.
55- Kurihara H.; Koda H.; Asami S.; Kiso Y.; Tanaka T. (2002)
Contribution of the anti oxidative property of astaxanthin to its protective effect on the promotion of cancer metastasis in mice treated with resistant stress. Life Sci. 70(21): 2509-20.
56- Tanaka T.; Makita H.; Ohnishi M.; Mori H.; Satoh K.; Hara A. (1995)
Chemoprevention of rat oral carcinogenesis by naturally occurring xanthophylls, astaxanthin and canthaxanthin. Cancer Res. 55 (18): 4059-4064.
57- Tanaka T.; Morishita Y.; Suzui M.; Kojima T.; Okumura A.; Mori H. (1994)
Chemoprevention of mouse urinary bladder carcinogenesis by the naturally occurring carotenoid astaxanthin. Carcinogenesis 15(1): 15-19.
58- Tanaka T.; Kawamori T.; Ohnishi M.; Makita H.; Mori H.; Satoh K.; Ha A. (1995)
Suppression of azoxymethane-induced rat colon carcinogenesis by dietary administration of naturally occurring xanthophylls astaxanthin and canthaxanthin during the postinitiation phase. Carcinogenesis 16(12): 2957-63.
59- Rousseau EJ.; Davison AJ.; Dunn B. (1992)
Protection by beta-carotene and related compounds against oxygen-mediated cytotoxicity and genotoxicity: implications for carcinogenesis and anticarcinogenesis. Free Radic Biol Med 13(4): 407-33.
60- Kozuki Y.; Miura Y.; Yagasaki K. (2000)
Inhibitory effects of carotenoids on the invasion of rat ascites hepatoma cells in culture. Cancer Lett 151(1): 111-5
61- Gradelet S.; Le Bon AM.; Berges R.; Suschetet M.; Astorg P. (1998)
Dietary carotenoids inhibit aflatoxin B1-induced liver preneoplastic foci and DNA damage in the rat: role of the modulation of aflatoxin B1 metabolism. Carcinogenesis (3): 403-11.
62- Black HS. (1998)
Radical interception by carotenoids and effects on UV carcinogenesis. Nutr Cancer 31(3): 212-7.
63 - Nishino H.; Murakosh M.; Ii T.; Takemura M.; Kuchide M.; Kanazawa M.; Mou XY.; Wada S.; Masuda M.; Ohsaka Y.; Yogosawa S.; Satomi Y.; Jinno K. (2002)
Carotenoids in cancer chemoprevention. Cancer Metastasis Rev. 21(3-4): 257-64.
64- Li Z.; Wang Y.; Mo B. (2002)
The effects of carotenoids on the proliferation of human breast cancer cell and gene expression of bcl-2. Zhonghua Yu Fang Yi Xue Za Zhi. 36(4): 254-7.
65- Chew BP.; Park JS.; Wong MW.; Wong TS. (1999)
A comparison of the anticancer activities of dietary beta-carotene, canthaxanthin and astaxanthin in mice in vivo. Anticancer Res 19(3A): 1849-53.
66- Hansen KB.; Tauson AH.; Inborr J. (2001)
Effect of supplementation with the antioxidant astaxanthin on reproduction, pre-weaning growth performance of kits and daily milk intake in mink. J Reprod Fertil Suppl. 57: 331-4.
67- Lignell et al. (1998)
Method of increasing the production and improving the quality of semen. WO99/29313.
68- Lyons NM.; O’Brien NM. (2002)
Modulatory effects of an algal extract containing astaxanthin on UVA-irradiated cells in culture. J Dermatol Sci (1): 73-84.
69- Savoure N.; Briand G.; Amory-Touz MC.; Combre A.; Maudet M.; Nicol M. (1995)
Vitamin A status and metabolism of cutaneous polyamines in the hairless mouse after UV irradiation: action of beta-carotene and astaxanthin. Int J Vitam Nutr Res 65(2): 79-86.
70- Skin et al. (2001)
Effects of astaxanthin from Haematococcus pluvialis on human skin. Fragrance Journal 12: 98-103.
71- Yamahita et al, (1995)
Suppression of post-UVB hyperpigmention by topical astaxanthin from krill. Fragrance Journal 14: 180-185.
72- R. Todd Lorenz.
Method for retarding and preventing sunburn by UV light. R. Patent no. US 6,433,025 B1 Cyanotech corporation.
73- Anderson, M. (2001)
Method of Inhibiting 5-a Reductase with Astaxanthin to Prevent and Treat Benign Prostate Hyperplasia (BPH) and Prostate Cancer in Human Males. US Patent #6277417.
74- Østerlie M.; Bjerkeng B.; Liaaen-Jensen S. (1999)
On bioavailability and deposition of bent Z-isomers of astaxanthin. In: Pigments in Food Technology. Proceedings of 1st International Congress PFT (Minguez Mosquera, M. I., Galan, M. J. & Mendez, D. H., eds) pp. 157-161. International Congress on Pigments in Food Technology, Sevilla, Spain
75- Østerlie M.; Bjerkeng B.; Liaaen-Jensen S. (1999)
Blood appearance and distribution of astaxanthin E/Z isomers among plasma lipoproteins in humans administered in a single meal with astaxanthin. Abstract 2A-13. Presented at the 12th International Symposium on Carotenoids in Cairns, Queensland, Australia, July 18-23, 1999.
76 - Østerlie M.; Bjerkeng B.; Liaaen-Jensen, S. (2000)
Plasma appearance and distribution of astaxanthin E/Z and R/S isomers in plasma lipoproteins of men after single dose administration of astaxanthin. J. Nutr. Biochem. 11: 482-490.